がん治療や在宅医療が進み、在宅療養するがん患者は年々増加しており、薬局でもオピオイド鎮痛薬に関わる必要性が高まっています。
医療用麻薬として分類されるオピオイド鎮痛薬も多く、これまで取扱うことが少なかった薬剤師は不安に感じているのではないでしょうか。
今回の記事では在宅医療で使われる主なオピオイド鎮痛薬の特徴について解説します。
今回紹介するオピオイド鎮痛薬は以下の4つです。
- モルヒネ
- オキシコドン
- フェンタニル
- ヒドロモルフォン
他にもメサドン、タペンタドール、ブプレノルフィンだったり弱オピオイドとしてトラマドール、コデインもありますが、今回の記事では上記の4種類に焦点をあてて解説します。
他のオピオイド (メサドン、タペンタドール、トラマドール、コデインなど) については機会があれば紹介します。
在宅医療において、今回紹介する4種類をおさえておけば大半の疼痛コントロールに対応できます。
どれを使えば良いのか・・・
基本的にはどれでも良いです。
緩和医療学会ガイドラインでもWHOでもどれも推奨されています。
ただし、少しずつ特徴が異なるので患者によって使い分ける必要があります。
今回の記事ではそれぞれの特徴について解説します。
換算については別記事で問題形式で紹介しています。

今回の記事を読むことで在宅医療で使われるオピオイド鎮痛薬の特徴を理解して、服薬指導や提案に結びつけることが出来ます。
少し長くなりますが、お付き合いください。
オピオイド鎮痛薬の基礎
定義と概要
まず、オピオイドとはオピオイド受容体に親和性を示す薬物の総称です
特に鎮痛作用など医療に有効なものを医療用麻薬やオピオイド鎮痛薬とも呼ばれています。
用量については人によって効果に個人差があるので患者ごとに適切な量を決定します→タイトレーションと呼びます。
薬効・副作用と作用機序
簡単にオピオイド鎮痛薬が持つ薬効と副作用、その作用機序を記載します。
鎮痛
脊髄や脳に存在するμオピオイド受容体を介する
上行性痛覚情報伝達を抑制することによる直接的な鎮痛作用を発揮します。
また、ノルアドレナリン・セロトニン神経系をからなる下行性抑制系を活性化することで鎮痛効果を示します。
鎮咳
延髄孤束核のオピオイド受容体に直接作用し、鎮咳作用を示します。
呼吸困難の緩和
延髄の呼吸中枢抑制作用で努力呼吸と呼吸困難の緩和をもたらします。
ただし、呼吸困難に対して適応をもつ薬剤はありません。
悪心・嘔吐 (催吐) 作用
モルヒネでは鎮痛効果を発現する必要量の1/10で起こります。
作用機序は以下の3つで引き起こされると考えられています。
- 延髄の第四脳室底にある化学受容器引金帯 (chemoreceptor trigger zone: CTZ) のオピオイドμ受容体を刺激することにより、ドパミンが遊離され、ドパミンD2受容体が活性化されることで、嘔吐中枢に刺激が伝わり症状が発現する。
- 前庭器のオピオイドμ受容体を刺激することによりヒスタミンが遊離され、ヒスタミン受容体が活性化されることで、嘔吐中枢に刺激が伝わり症状が発現する。
- 消化管を直接刺激することにより消化管蠣動運動が抑制され、胃内容物の停留を引き起こすことで求心性迷走神経を介してCTZが刺激され、嘔吐中枢に刺激が伝わり症状が発現する。
モルヒネ
概要
▶がん疼痛の標準治療薬として古くから使用されております。
▶剤形が非常に豊富です。
▶オキシコドンやフェンタニルで取り切れない痛みでもモルヒネならなんとかしてくれるという信頼があります。
▶呼吸困難に対してもエビデンス豊富で、鎮咳薬としても使用されるコデインがモルヒネの前駆体ということもあり、鎮咳作用も強い
▶肺がんでは特に鎮咳作用を期待してモルヒネが使用されることが多い印象です。
剤形
前述したようにモルヒネの特徴として剤形が豊富であることが挙げられます。
- 注射剤 (高濃度規格、プレフィルド製剤あり)
- 散剤 (原末・徐放細粒)
- 錠剤・カプセル剤 (速放製剤、徐放性製剤)
- 液剤
- 坐剤
上記のように速放製剤、徐放性製剤含めて様々な剤形があるため、患者に合わせて適当な投与経路を選択することが出来ます。
注射剤
1%製剤と高濃度である4%製剤の2つの規格があります。
取違には十分配慮する必要がありますが、高用量になっても皮下注継続することが出来ることはとても便利です。
皮下は1mL/hが上限となっているので、これを超えるようであれば高濃度に切り替えます。
また、プレフィルドシリンジ製剤 (モルヒネ塩酸塩注100mgシリンジ「テルモ」) もあります。
これはテルフュージョン小型シリンジポンプを使用する場合に、そのままセット出来るので、相性抜群です。
PCAポンプについては以下の記事で詳細に解説しています。

散剤
原末は非常に安価で、金額を抑えたい方には良いかもしれません。
調剤する際には倍散を作成しておくことを推奨しますが、その際、麻薬管理帳簿には倍散ごとに口座 (ページ) を作成する必要があります。
また、徐放性の散剤として、モルヒネ硫酸塩水和物徐放細粒 (旧:モルペス細粒) があります。
胃ろうからの投与が可能な徐放性製剤はモルヒネだけです。
懸濁は水ではシリンジ内などに細粒が残存するため、単シロップ、乳製品 (牛乳、ヤクルト、経管栄養剤など) を用いると懸濁しやすいです。
錠剤・カプセル剤
錠剤とカプセル剤についても多くの規格がラインナップされています。
普通錠 (速放性) は使用されることは少ないですが薬価が安いです。
定時投与する場合は1日6回の投与が必要です。
MSコンチン®錠、MSツワイスロン®カプセル、パシーフ®カプセルは徐放性製剤です。
このうちMSコンチン®錠とMSツワイスロン®カプセルは12時間ごとの投与であり、
パシーフ®カプセルのみ24時間ごとの投与となっております。
MSツワイスロン®カプセル、パシーフ®カプセルは共に経管投与も可能であるため胃ろうの患者にも使用できます。
投与間隔の違いに注意しつつ、患者の服用しやすさで使い分けることが可能です。
パシーフ®カプセルはMultiple Unit型製剤であり、速放性粒と徐放性粒が2:8の割合で配合されており、血中濃度の早い立ち上がりと持続性を併せ持っています。
液剤
オプソ®内服液は液剤であるため飲みやすくレスキュー用の薬剤として、使われることが多いです。
定時投与する場合は他の速放性製剤と同様に4時間ごとに1日6回投与します。
味はモルヒネの苦みをマスキングされ、飲みやすいと言われております。
坐剤
坐剤もモルヒネだけの剤形であり、商品名はアンペック®坐剤です。
使いどころは内服が難しくなってきたときのレスキュー薬として、注射剤が使えないときや変更するまでの繋ぎとしても使用されます。
内服よりも初回通過効果は小さくなります。
体内動態
モルヒネは経口投与時のバイオアベイラビリティが低く約24%と、初回通過効果が大きい薬物です。
分布容積は約231Lと大きいため腹水や浮腫あっても血中濃度の変動を考慮する必要はないとされています。
モルヒネは腎機能低下では使いにくいと言われるので、腎排泄型と思われがちですが、実は肝代謝型の薬物です。
モルヒネは肝臓でグルクロン酸抱合され、代謝物としてmorphine-3-gluclonide (M3G) とmorphine-6-gluclonide (M6G) に代謝されます。
M3Gはオピオイド受容体への親和性はほとんどありませんが、ミオクローヌスやせん妄の原因となる神経毒性を有しています。
一方、M6Gは全体の10%ですが、活性代謝物でありモルヒネを上回るオピオイド活性を持ちます。
腎機能障害患者ではいずれの代謝物も蓄積する可能性があり、副作用が生じる可能性が強まるため注意が必要です。
オキシコドン
概要
現在 (2023年7月時点) において、今回紹介するオピオイド鎮痛薬の中では最も使用されているものではないでしょうか。
▶けしの実から抽出されたアヘンから精製されたアヘンアルカロイドであるテバイン(別名
パラモルフィン)から合成された、強オピオイドです。
▶神経障害性疼痛にも有効性が高いという報告もありますが、基本的には効果・副作用はモルヒネと同じと考えて良いです。
▶注射は用量換算もモルヒネと等価です。
▶呼吸困難感についてもエビデンスはモルヒネほどではありませんが、効果はあると考られており、「癌患者の呼吸器症状の緩和に関するガイドライン」でも推奨されています。
▶主に肝代謝型であるが、代謝物に活性はなく、腎機能低下による蓄積は問題になりません。
注射がない頃は内服できなくなり、注射にする場合にはモルヒネに変更せざるを得ませんでしたが、2012年にオキファスト注が発売され、継続できるようになりました。
それも追い風となったのか、現在ではオキシコドン製剤が主要なオピオイドでは使われることが多いです。
剤形
注射剤
前述の通り、注射剤は2012年に先発品オキファスト®注が発売されています。
また、後発品もオキシコドン注射液として流通しています。
どちらも10mgと50mgの規格が存在しますが、濃度に関しては同じ1%です。
高用量になった場合にはモルヒネやヒドロモルフォンの高濃度規格に変更せざるを得ないことがあるので、高濃度規格の発売を期待しています。
速放性製剤
オキシコドンの速放性製剤として現在流通しているのは先発品であるオキノーム®散と後発品であるオキシコドン錠NX、オキシコドン内服液です。
オキノーム®散は非常によく使われている速放性製剤です。
オピオイドをこれから開始する方に初めてのオピオイド鎮痛薬として導入されることも多い印象です。
規格は2.5mg、5mg、10mg、20mgの4規格あり、濃度がそれぞれ異なっているので、成分量 (mg) なのか製剤量 (g) なのか口頭で話す場合は特に気を付けましょう。下記の表を参考にしてください。
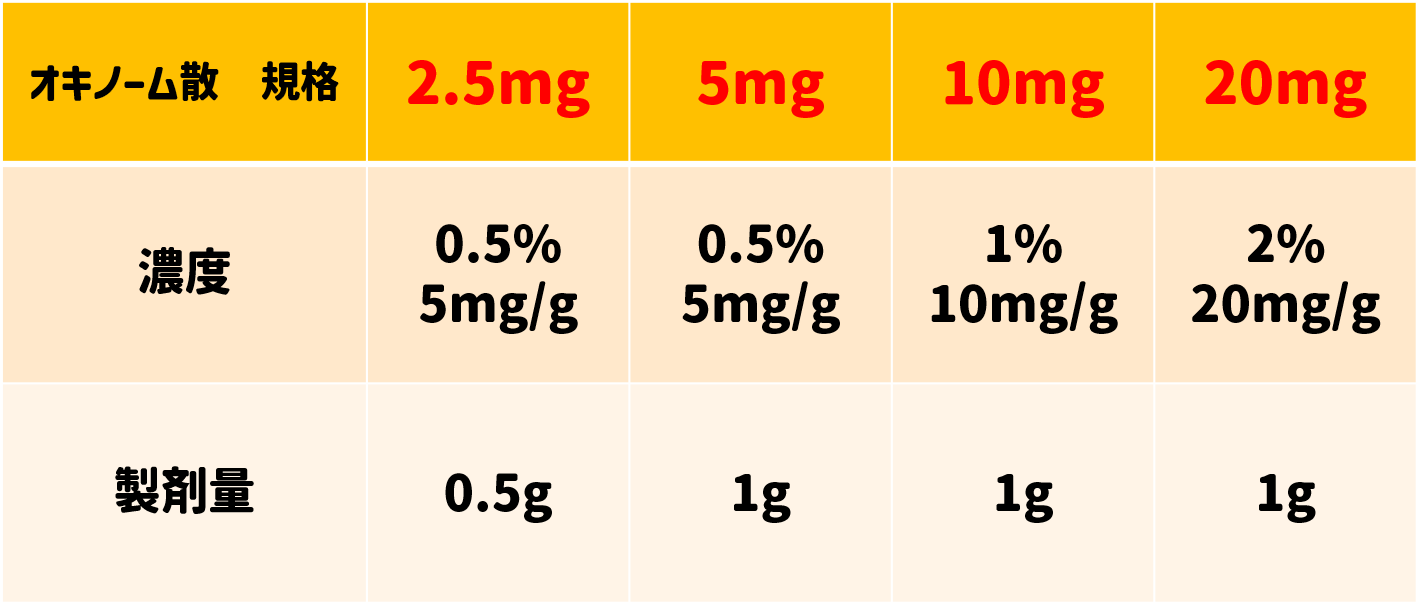
定時投与する場合には6時間ごとに1日4回服用します。
後発品としては錠剤であるオキシコドン錠NXがあります。
(NXの意味については徐放性製剤の項で詳細解説)
また、オキシコドン内服液という液剤も存在します。
散剤が飲みづらいという方に対して提案することもあります。
味は甘く、人によっては甘すぎると感じる場合もあるようです。
ただし、あまり流通していないようなので、事前に卸に確認するようにしましょう。
徐放性製剤
先発品はオキシコンチン®TR錠です。
TRは「Time Release」の略で徐放を意味しています。
が、改変防止製剤であることを表示しています。
粉砕は出来ず、水に入れるとゲル化するため注射として乱用することを防止しています。
一方で後発品はオキシコドン徐放錠NX、オキシコドン徐放カプセルがあります。
オキシコドン徐放錠NXの「NX」はナロキソンを意味しています。
麻薬拮抗薬であるナロキソンは内服すると初回通過効果により効果を発揮しませんが、錠剤を溶かして注射として使用とすると拮抗作用を発現するため、こちらも注射として乱用することを防止しています。
在宅医療で使うなら改変防止製剤の方が安心ですね。
体内動態
オキシコドンは経口投与時のバイオアベイラビリティが約73.5%であり、初回通過効果はモルヒネより小さいです。
オキシコドンは主に肝臓でCYP3A4によって非活性物質であるノルオキシコドンへ代謝されます。
しかし、一部はCYP2D6によってオキシコドンの約14倍の鎮痛効果がある活性代謝物オキシモルフォンへ代謝されます。
(ただし、その割合は非常に低いので臨床上問題になることは少ないと考えられています)
腎機能障害による蓄積は問題になることはほとんどないため、腎機能障害の患者にも使用することが出来ます。
まとめ・使い方
オキシコドンは現在、がん治療の主流となっており、出番は多いです。
まず、医療用麻薬の導入時において「モルヒネ」という言葉に不安を感じる患者は少なくありません。
そのような時に名前が違うだけですすめやすいということもあります。
オキノーム散から初めて、徐放性製剤に変更し、注射に切り替えると最初から最後まで使用できます。
また、腎不全でモルヒネが使いにくい方でもオキシコドンなら使用可能なので、患者選択に制限がないことも特徴ですね。
また在宅医療においては採用品目に制限がないため、特殊なオキシコドン内服液も選択肢として考えておくと、良い提案ができるかもしれません。
フェンタニル
概要
合成麻薬の強オピオイドであり、今回紹介する他のオピオイド鎮痛薬とは構造が大きく異なります。
ただし作用機序や薬理作用はモルヒネと同様で、μ受容体に選択的に作用します。
麻酔補助薬として長く使用されていますが、がん疼痛にも使用されています。
一番の特徴は脂溶性が高く、剤形が特殊であることでないでしょうか。
フェンタニルは注射剤の他に貼付剤、粘膜吸収製剤と他のオピオイド鎮痛薬にはない剤形があります。
特に内服できなくなった場合に有用と考えられます。
また、吐き気や便秘など消化器系の副作用が少なめです。
剤形
注射剤
フェンタニル注射液として0.1mg、0.25mg、0.5mgの3規格が存在しています。
ガイドラインでは他のオピオイド鎮痛薬と同様に推奨されておりますが、在宅では使用されることが少ないです。
理由として1つは呼吸抑制に特に注意が必要であることが考えられます。
死亡につながる呼吸器症状の副作用発生リスクが他のオピオイド鎮痛薬より高いためです。
もう1つの理由としては製剤としての濃度が低いことが考えられます。
モルヒネ注1%で24mg/日投与した場合を考えると0.1mL/時間の投与速度となります。
一方でフェンタニル注の場合、同等の投与量は0.48mg/日となりますが、投与速度は0.4mL/時間となり、モルヒネ注の4倍となっています。
皮下注の上限である1mL/時間をすぐに超えてしまうことや、薬液の更新タイミングが頻繁になることも在宅医療では問題になることが多いです。
上記のように在宅医療ではがん疼痛治療でフェンタニル注射が使われていない理由が考察できます。
経皮製剤
フェンタニルががん疼痛治療に最も使用されるのは経皮吸収型製剤です。
多くの種類があり、それぞれ推定吸収速度が同じでも製剤により規格が異なります。
以下の表を参考にしてください。
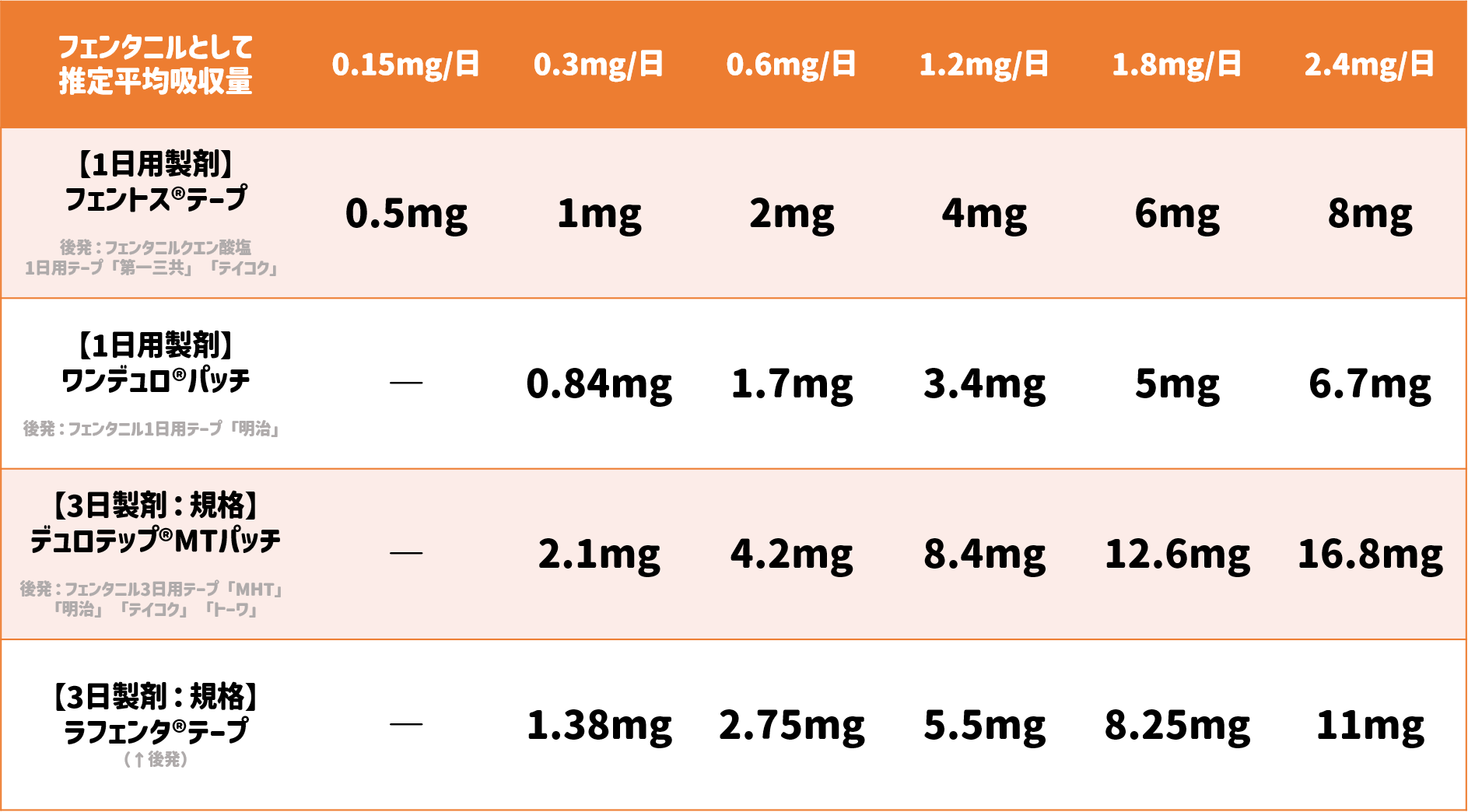
(↑フェンタニル貼付剤の推定吸収量と規格)
大きく分けて毎日貼り替える1日用製剤と3日に一度貼り替える3日用製剤があります。
先に発売されたのは国際基準であるデュロテップ®MTパッチ (3日用製剤) でしたが、日本ではフェントス®テープ (1日用) が圧倒的シェアとなっています。
毎日入浴する日本人に合っていることが一番の理由として挙げられます。
(入浴を避ける理由は後述します)
入浴だけが理由であればワンデュロ®パッチも1日用製剤でありますが、もう1つの理由としては規格表記の分かりやすさです。
上の表を見てお分かり頂けるように同じ吸収速度でもそれぞれの製剤で規格が異なります。
ワンデュロ®パッチは0.84mg、1.7mg、3.4mg・・・に対して、フェントス®テープは同じ吸収速度の製剤でも1mg、2mg、4mg・・・と感覚的に分かりやすくなっています。
これらのことから日本ではフェントス®テープが最もよく使用されています。
経皮吸収型製剤は以下の3点に注意してください。
- 貼付部位を温めない
- 増量間隔は72時間以上
- 初回は0.5mgから
貼付部位を温めると吸収速度が促進され血中薬物濃度が急激に上昇する可能性があります。
そのため入浴時には避けることとされています。
また貼付部位は胸部、腹部、上腕部、大腿部等とされており、背中など熱がこもりやすい部位への注意は避ける必要があります。
在宅医療では本人が剝がさないようにと介護者が背中に貼付する場合があるので、気を付ける必要があります。
増量間隔については72時間以上あける必要があります。
経皮吸収型製剤では血中濃度が安定するまでには36~48時間かかるとされています。
したがって増量したからといってすぐに効果は出ません。
毎日増量してしまうと血中濃度が数日後にも上がり続け、過量投与となる恐れがあります。
始めてオピオイドを使用する患者にはフェントス®テープ (フェンタニルクエン酸塩1日用テープ) 0.5mgから使用することとなっています。
実は以前は1mg規格しか存在しておらず、初回投与は避けることとなっていました。
フェントス®テープ1mgはモルヒネ経口30mg/日に相当します。
概ね安全であるとは確認されていましたが、経口投与と違って過量投与となって、患者が意識がなくなった場合、経皮吸収はされ続けることになります。
1mgが最小規格であった頃は半面貼付などが行われていました。
そのような需要があり、0.5mg規格が発売され、0.5mgからであれば初回投与できるようになりました。
粘膜吸収製剤
突出痛治療のみに適応があり、定時投与することは出来ません。
製剤としては2種類、イーフェン®バッカル錠とアブストラル®舌下錠があります。
イーフェン®バッカル錠はバッカル部位 (奥歯の歯茎と頬粘膜の間) への投与であり、アブストラル®舌下錠は舌下投与です。
若干の違いはあるものの、どちらも非常に早く効くことが特徴です。
アブストラル®舌下錠のほうが広く流通している印象です。
他の速放性製剤では効果が出るまでに痛みがおさまるなど、痛みのピークに間に合わないことがありましたが、これらは痛みが出てから服用しても効果が期待できます。
突出痛だけある患者にベース増量をすると眠気が強く出てしまうため、安静時には疼痛は定時投与でおさえられているが、体動時などに突出痛のみがあるというケースで使用します。
ベースが足りないときのカバーとしては不適です。
必ずベースとなるオピオイド鎮痛薬が投与されていて、持続痛が適切に管理されている場合に限ります。
また、アブストラル®舌下錠の場合、ベースはモルヒネ経口60mg/日以上、オキシコドン経口40mg/日以上、フェントステープ2mg以上、ヒドロモルフォン経口12mg/日以上が適応となっている点にも注意してください。
粘膜吸収型製剤は投与量設定が問題となることがあります。
通常のレスキュー量の考え方としてはベース投与量の1/8~1/4などとされていますが、粘膜吸収型製剤ではベースによらず、突出痛だけで投与量をタイトレーションすることになります。
以下のフローを確認してください。
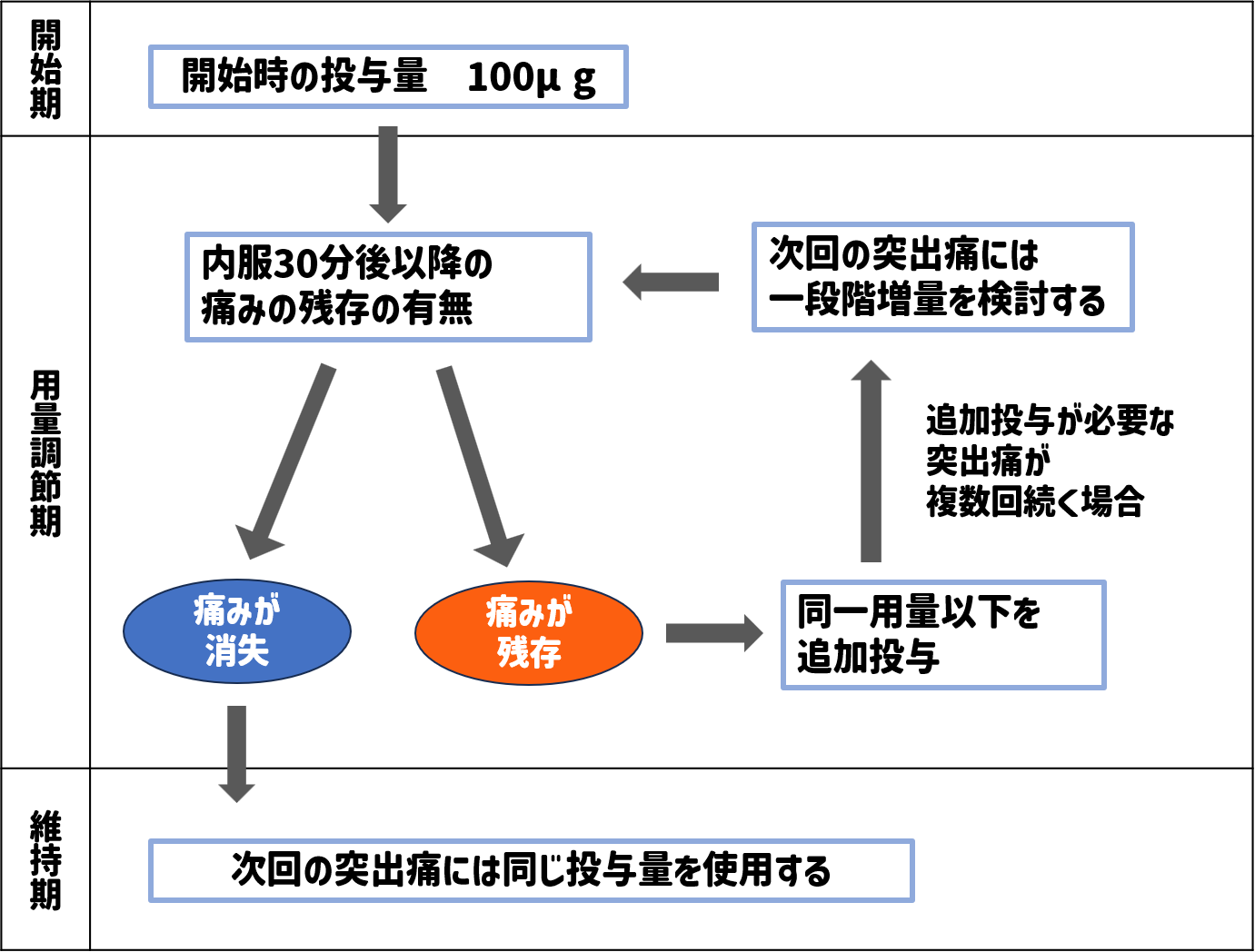
(↑アブストラル舌下錠 投与量設定の基本フロー)
また、1日の使用回数と投与間隔にも注意が必要です。
アブストラル®舌下錠では2時間以上、イーフェンバッカル®錠では4時間以上投与間隔をあける必要があります。
どちらも1日4回までの突出痛に対する投与にとどめることとなっています。
それ以上になる場合はベースの増量を検討します。
また、誤飲防止のため複数の規格を同時に処方してはいけないことも注意が必要です。
副作用・注意点
他のオピオイド鎮痛薬と比較して消化管系の副作用が少ないです。
μオピオイド受容体選択性が高く、消化管吸収の影響を受けないためであると考えられます。
また、モルヒネでせん妄などが起きた場合、フェンタニルにスイッチすることで改善することも報告されています。
呼吸抑制に注意が必要とされています。
また、鎮痛耐性が起こりやすいことも報告されているため、長期使用には注意が必要です。
体内動態
フェンタニルのバイオアベイラビリティは経皮吸収型製剤で92%、粘膜吸収型製剤で50%です。
肝臓でCYP3A4により薬理活性のないノルフェンタニルに代謝され、尿中排泄されます。
薬理活性を持つ代謝物はないため、腎機能障害でも蓄積が問題となることはありません。
また、血症蛋白結合依存性の薬物であるため低アルブミン血症などにより、遊離型血中濃度が上昇して過量になる可能性があるので注意してください。
まとめ・使い方
消化管閉塞などにより内服ができない患者に使用することが多くなります。
ただし痛みが程々で安定している場合で使用することに限られます。
在宅では貼付剤の方が介護者の負担も少ないため、安定している場合は貼付剤が優れています。
そのため、入院中は注射剤で疼痛管理して、退院時に負担を減らすために貼付剤に変更するケースもあります。
一方で、強い痛みのときは貼付剤では用量調節しづらいため、注射剤や他のオピオイドの経口製剤等の方が優れています。
また、フェントス®テープでは高用量になってくると効かなくなってくるため、8~12mgを超えたら他のオピオイドへのスイッチを検討してください。
また、フェンタニルは消化器系の副作用が少ないため他のオピオイドで副作用出現時に使用されることもあります。
モルヒネでせん妄、便秘ひどいとき、悪心出現時などに変更することがあります。
フェンタニルは貼付剤が特に在宅では使用しやすいオピオイド鎮痛薬ですが、取り扱いに注意が必要な点も多いので、理解して使いましょう。
ヒドロモルフォン
概要
モルヒネの誘導体の半合成麻薬です。
オキシコドン同様にモルヒネと構造が似ていて、効果・副作用ともにモルヒネと同様です。
日本においては2017年に発売されたこともあって「新しいオピオイド鎮痛薬」という認識がありますが、海外では100年前から使用されております。
そのため海外ではモルヒネと同様に呼吸困難の緩和にもエビデンスがあります。
剤形
内服
ヒドロモルフォンの換算は経口モルヒネの1/5となります。
徐放性製剤はナルサス®錠です。
特徴としては1日1回内服で良いことです。
これは在宅患者ではオキシコドン製剤よりも服用回数が少なく、服薬状況が悪い患者でも使いやすいです。
速放性製剤はナルラピド®錠があります。
見た目が徐放性製剤と速放性製剤で類似しているため、間違って服用しないように気を付けて指導する必要があります。
注射剤
注射剤は内服薬より1年遅れて2018年に日本国内で「ナルベイン®注」として発売されています。
規格は2mg/mL (0.2%) と高濃度規格である20mg/2mL (1%) の2規格があります。
したがってモルヒネと同様に高用量になったとしても皮下投与を継続できるという点で非常に使いやすいと考えます。
もちろん取り扱いには十分注意が必要です。
注意点として内服薬と注射剤において換算比が両方向性ではないという点です。
「内服薬→注射剤」は内服薬×1/5であるのに対して
「注射剤→内服薬」は注射剤×2.5とされています。
この換算比は一例であり、諸説あります。
いずれにしても注射剤から内服薬への変更の場合は少な目に変更した後にレスキュー薬を使用しながらタイトレーションする必要があります。
ただし、この考え方はヒドロモルフォン特有ではなく、他のオピオイド鎮痛薬についても投与経路変更やオピオイドスイッチをする場合には要注意です。
換算についてはモルヒネ注→ヒドロモルフォン注への変更については添付文書では
モルヒネ×1/8となっておりますが、約1/10と考えた方が覚えやすいですね。
モルヒネ・オキシコドンは換算量が同じで良いですが、ヒドロモルフォンの場合はこのように考え方が異なるので慣れるまで使いづらい点があります。
体内動態
ヒドロモルフォンの経口におけるバイオアベイラビリティは24%とされています。
モルヒネと同様に初回通過効果を受けます。
代謝についてはヒドロモルフォンは肝臓でグルクロン酸抱合を受け、hydromorphone-3-glcuronide(H3G)に代謝されるため、代謝酵素による相互作用はあまり問題とはなりません。
代謝物であるH3Gはオピオイド活性は弱く、尿中排泄されます。
ただしH3Gはモルヒネの代謝物であるM3Gと比較して神経興奮作用が2.5倍高いとされているため、腎機能障害患者では神経毒性の合併に注意する必要があります。
まとめ・使い方
ヒドロモルフォン自体は外海ではモルヒネ同様に長く使われてきており、呼吸困難へのエビデンスや、内服薬の服用回数が少ないこと、注射剤の高濃度規格が存在すること、腎機能障害患者にも比較的安全に使用できるなど、本来は第一選択となるべき特徴を多く有しています。
しかしながら、現在 (2023年7月時点) ではまだ使われることが少ないです。
現在主流であるオキシコドンから変える理由があまりないことだったり、モルヒネやオキシコドンとの換算が複雑であることが要因であると考察されます。
在宅医療では非常に使いやすいポイントが多くあるので、今後広まってくることが予想されます。
まとめ
最後までお付き合い頂き、ありがとうございます。
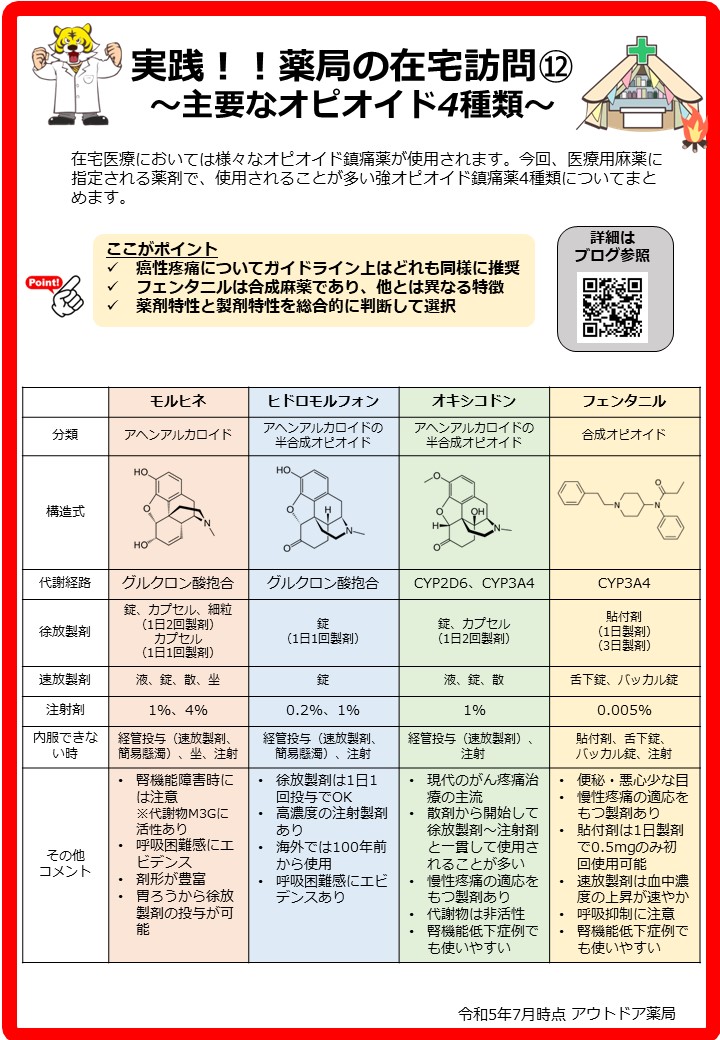
今回の記事では主要なオピオイド鎮痛薬4種類について解説しました。
ガイドライン上はどれも推奨されていますが、それぞれ製剤上の工夫や体内動態において異なる特性があります。
それぞれの特徴を理解しておくと服薬指導や処方提案の根拠が明確になります。
指導料を算定する場合には麻薬管理指導加算を算定することになるので、以下の記事も参考にしてください。

まとめ資料を以下に掲載しておきます。
ダウンロードして皆様の薬局でご活用ください。
𝕏(旧:Twitter)やInstagramでも在宅医療に関する情報発信しています。
LINE公式アカウント登録して頂くと、必要な記事を簡単に検索できます!
使い方はこちら↓

参考資料
- 医療用麻薬のトリセツ

- 緩和治療薬の考え方、使い方ver.3

- 緩和医療薬学

- がん疼痛の薬物療法に関するガイドライン(2020年版)

- がん患者の呼吸器症状の緩和に関するガイドライン(2016年版)







